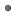Liebe Pflanzenfreunde,
nach längerer Zeit Pause möchte ich heute in einem kurzen Artikel Schnitte vom Blatt der Kriechenden Japanischen Kopfeibe (Cephalotaxus harringtonii var. harringtonii, Zuchtform "Prostrata") zeigen. Die Schnitte hat Herr Rolf-Dieter Müller letzte Woche auf dem 14. Kornrade -Treffen in Darmstadt gemacht und nach dem Blick durch Mikroskop auf einen der frischen Schnitte habe ich mich spontan entschlossen, diesen fertig zu präparieren.
Wie üblich, aber zunächst etwas zur Pflanze selbst:
Die Familie der Kopfeibengewächse (Cephalotaxacea) gehört mit ihrer einzigen Gattung Chephalotaxus in die Ordnung der Coniferales und steht dort neben der Familie der Eibengewächse (Taxacea), mit der sie eng verwand ist. Die Japanische Kopfeibe (Cephalotaxus harringtonii) ist eine von 11 Arten in der Gattung. Von ihr gibt es 4 Varietäten und diverse Zuchtformen, da sie in Japan und seit 1829 auch in Europa und später Amerika für Zier- und Landschaftsgärten kultiviert wurde und wird.
Bild 1: Große männliche Japanische Kopfeibe (Cephalotaxus harringtonii var Harringtonii) im Botanischen Garten Bonn

Unsere Kriechende Japanische Kopfeibe gehört zur Varietät Harringtonii und ist eine Prostata genannte, bodendeckende Zuchtform mit nur rund 60 cm Wuchshöhe. Die Urform ist in Japan beheimatet, ihr Verbreitungsgebiet reicht von Kyushu bis Hokkaido, mit einem Schwerpunkt in Hondo.
Bild 2: Die Kriechende Japanische Kopfeibe (Cephalotaxus harringtoniie var. harringtonii, Zuchtform "Prostrata") im Botanischen Garten Darmstadt

Die ersten Kopfeiben oder Pflaumeneiben (Cephalotaxus) Exemplare, es waren Cephalotaxus harringtonia, schickte Philipp Franz von Siebold 1829 von Japan nach Europa (Belgien). Kopfeibe ist die wörtliche Übersetzung des wissenschaftlichen Gattungsnamens Cephalotaxus. Der Name Pflaumeneibe kommt von den großen, pflaumenartigen Samen, die im reifen Zustand rötlich braun gefärbt und um 3 cm lang sind.
Die Japanische Kopfeibe wächst je nach Varietät als immergrüner, kleiner Baum oder Strauch, der Wuchshöhen von unter einem Meter bis zu maximal 10 Meter erreicht. Die graue Borke schält sich in dünnen Längsstreifen ab. Die Zweige sind erst grün und später rötlich braun. Die nadelförmigen Blätter sind etwa 3 bis 6 cm lang und 2 bis 4 mm breit. Sie sind am Zweig spiralig angeordnet, bei seitlichen Zweigen kann die Benadelung zweizeilig wirken. Auf der Blattunterseite sind deutlich zwei Stomatabänder erkennbar, die jeweils aus 11 bis 24 Reihen Stomata bestehen. Durch austretendes Harz zur Verdunstungsregulierung wirken sie meist weiß belegt.
Bild 3: Stamm einer kleineren Pflanze aus Bonn

Bild 4: Blattoberseite der Japanischen Kopfeibe mit der Mittelrippe und einer Schwebfliege (Syrphidae)

Bild 5: Blattunterseite der Japanischen Kopfeibe mit den beiden Stomatabändern

Chephalotaxus harringtonii ist eine zweihäusig getrenntgeschlechtige (diözische) Art. Die weiblichen Zapfen stehen an relativ langen Stielen an den Zweigenden einzeln oder bis zu sechst zusammen. In ihnen stehen kreuzgegenständig mehrere Paare Deckschuppen. Jede besitzt zwei achselständige, aufrechte Samenanlagen, von denen sich meist nur eine entwickelt. Samenschuppen sind nicht erkennbar. Der Bestäubungstropfen ist relativ groß und lange haltbar. Die Blütezeit reicht von März bis April und die Samen beginnen ab September des folgenden Jahres zu reifen, dies unterscheiden die Kopfeiben von den Eiben. Die Samen werden etwa 2 cm lang und sind von einem Samenmantel (Arillus) umgeben. Dieser ist rötlich-hellbraun (nussbraun) und hat eine ovale Form mit etwa 3 Zentimeter Länge.
Bild 6: Reife Samen an einer Japanischen Kopfeibe aus dem Botanischen Garten in Berlin (Bild der Gartenverwaltung, CC BY-SA 3.0)

Die männlichen zapfenartigen Blüten stehen an Zweigen des Vorjahres zu sechst bis acht köpfchenartig auf einem kurzen Stiel zusammen. Sie enthalten 4 bis 16 Microsporophylle mit je meist drei (selten zwei oder vier) Pollensäcken. Die Pollenausbreitung erfolgt durch Wind.
Bild 7: Männliche Zapfen mit offenen Microsporophyllen an der Pflanze aus Bild 1 in Bonn

Wie bei alle Kopfeiben sind auch bei der Japanischen Kopfeibe viele Pflanzenteile giftig, da sie Cephalotaxine enthalten. Ein Öl aus dem Samen wird teilweise zur Behandlung von Leukämie eingesetzt - das scheint aber eine riskante Therapie zu sein.
Die Samenhülle jedoch ist essbar und bei voller Reife sehr süß. Der Geschmack ist etwas eigenartig würzig, aber nicht unangenehm. Vorsicht! Wer hier probieren möchte, muss unter allen Umständen vermeiden, den Samen anzubeissen. Die Samenhaut muss mit den Lippen ab gelutscht werden, die Zähne haben Pause. :)
Bild 8: Illustration von Cephalotaxus harringtonii von J.N.Fitch lith. - Curtis's Botanical Magazine, London., vol. 135 (gemeinfrei)
 Literatur
Literatur
[1]
Botany for Degree Students - Gymnosperms, Vasishta/Sinha/Kumar, S.Chand. 2008
[2] Transfusion tissue in gymnosperm leaves, Yu-Shi Hu, Bi-Jun Yao, Botanical journal of the Linnean Society, 83(3), S. 263-272, 1981
[3]
Wikipedia zur Japanischen Kopfeibe
[4]
Wikipedia zu den Kopfeiben allgemein
Präparation:
Die Probe in Form eine Blattes hat Herr MĂĽller am Rande der letzten Kornrade von einer Pflanze im Botanischen Garten der TU Darmstadt genommen. Zwischen Probenahme und Schnitt lagen etwa 2 Stunden.
Geschnitten hat er die frische Nadel auf dem Haga Kastenmikrotom. Die Schnittdicke beträgt rund 40 µm.
Nach einer Schnittfixierung in AFE für ca. 20 Minuten wurden die Schnitte in Aqua dest überführt und für gut 90 Sekunden mit Klorix (1:4 in Aqua dest. als Ersatz für Eau de Javelle) behandelt. Nach sehr gutem Ausspülen konnte gefärbt werden (die Nase darf über den Schnitten keinen Chlorgeruch mehr wahrnehmen).
Gefärbt habe ich mit W3Asim II nach Rolf-Dieter Müller für 7 Minuten mit einmaligem kurzen Erwärmen bis kurz vor den Siedepunkt. Eine Beschreibung der Färbung findet Ihr hier:
W3Asim II im Vergleich auf der Seite des MKB.
Nach der Färbung wurden die Schnitte in Aqua dest. gespült und für einige Minuten in Ethanol 70% differenziert.
Eingedeckt sind die Schnitte - nach gründlichem Entwässern in reinem Isopropanol - in Euparal.
Technik:
Alle Aufnahmen auf dem Leica DME mit den den 5x und 40x NPlanen sowie den 10x und 20x PlanApos. Die Kamera ist eine Canon Powershot A520 mit Herrmannscher Okularadaption. Zur Zeit nutze ich ein Zeiss KPL 10x, das mit den Leica-Objektiven sehr gut harmoniert. Die Steuerung der Kamera erfolgt am PC mit PSRemote und der Vorschub manuell anhand der Skala am Feintrieb des DME.
Alle Mikroaufnahmen sind mit Zerene Stacker V1.04 (64bit) gestackt. Die anschließende Nachbereitung beschränkt sich auf die Normalisierung und ein leichtes Nachschärfen nach dem Verkleinern auf die 1024er Auflösung (alles mit XNView in der aktuellen Version). Bei stärker verrauschten Aufnahmen lasse ich aber auch mal Neat Image ran.
Und nun zu den Schnitten!
Die auffällige Mittelrippe des Blattes springt uns auch im mikroskopischen Bild sofort an. Darunter liegt allerdings kein voluminöses Leitbündel, sondern es handelt sich einfach um eine vergrößerte Oberfläche des Assimilationsparenchyms.
Bilder 9a,b: Blattquerschnitt in der Übersicht, Bild 9b mit Beschriftung; Vergrößerung 50x, Stapel aus je 36 Bildern


Wir sehen den grundsätzlichen Aufbau eines Blattes mit beidseitig ausgeprägter Cuticula auf einer einlagigen Epidermis, darunter an der Blattoberseite das Assimilationsparenchym in der ersten Zelllage als Palisadenparenchym. Darunter im Schwammparenchym ein flaches geschlossen kollaterales Leitbündel in einer mehrreihigen Leitbündelscheide. An den rändern ein ausgeprägtes Transfusionsgewebe aus Transfusionstracheiden. Unter dem Leitbündel der einzige Harz- oder Sekretgang des Blattes mit einem gut ausgeprägten inneren Drüsenepitel. An der Blattunterseite rechts und links der Blattmitte liegen in Reihen die Stomata vom Coniferales-Typ.
Informationen zu den AbkĂĽrzungen im Bild 9b sowie den folgenden beschrifteten Bildern findet Ihr wie immer auf der Webseite des MKB:
Tabelle mit den Kürzeln und den zugehörigen allgemeinen Erläuterungen.
Schauen wir etwas genauer hin, zunächst noch einmal das Mittelstück des Blattes. Um die korrekte Ausrichtung zeigen zu können, habe ich die folgenden Bilder hier einmal im Hochformat mit einer Höhe von 1024 Pixeln statt der bisherigen 800 Pixel eingestellt. Bitte gebt mir eine kurze Rückmeldung, wenn das zu groß sein sollt.
Bilder 10a,b: Mittelrippe, Leitbündel und Harzgang, Bild 10b mit Beschriftung; Vergrößerung 100x, Stapel aus je 26 Bildern


Wir finden alle anatomischen Merkmale aus der Beschreibung zu den Bildern 9a,b wieder, auch wenn vieles nun deutlicher zu erkennen ist.
Es fehlt natĂĽrlich der Blattrand, der kommt nun:
Bilder 11a,b: Blattrand, Bild 11b mit Beschriftung; Vergrößerung 100x, Stapel aus je 25 Bildern


Hier sind schön das fortgesetzte Palisadenparenchym an der Blattoberseite und die aufgereihten Stomata an der Blattunterseite zu sehen.
Das LeitbĂĽndel ist immer einen genauen Blick wert!
Bilder 12a,b: Geschlossen kollaterales Leitbündel mit Transfusionstracheiden und Harzgang; Bild 12b mit Beschriftung; Vergrößerung 200x, Stapel aus je 27 Bildern


Zwischen dem oben liegenden Xylem und dem Phloem darunter fehlt ein Cambium, was den geschlossen kollaterale Bündeltyp ausmacht. rechts und links der Leitbündelscheide liegen jeweils mehrere Transfusionstracheiden, die dem Leitbündel längs folgen. Unter dem Leitbündel dann der schon aus den vorangegangenen Bildern bekannte Harzgang mit dem innen liegenden Drüsenepitel, in dessen Zellen das Harz gebildet wird.
Im Bild 10 sind Ihnen sicher schon die netzförmigen Strukturen in den Zellen des Assimilationsparenchyms aufgefallen. Was das wohl ist? Da müssen wir natürlich auch noch mal genauer hin sehen.
Bilder 13a,b: Assimilationsparenchym mit Resten der Chloroplasten, Bild 13b mit Beschriftung; Verbrößerung 200x, Stapel aus je


Die Präparation im Schnelldurchgang beschert hier nicht nur die in allen Bildern zahlreich zu findenden kleinen Artefakte, sondern hat auch dazu geführt, dass die im Schnitt liegenden unverletzten oder nur leicht angeschnittenen Zellen nicht gänzlich vom Zellinhalt befreit wurden. Das fällt insbesondere in den Zellen des Palisadenparenchyms auf, in denen die Begrenzungswände der dicht gepackten Chloroplasten stehen geblieben sind. Dort hat sich das Acridinrot der W3Asim II Färbung angelagert, was zu den netzförmigen Strukturen führt.
Zum SchluĂź noch einen Blick auf die Stomata vom Coniferales-Typ:
Bilder 14a-d: Zwei Stomata in unterschiedlich großen Z-Stapeln, Bilder 14b & d mit beschriftung; Vergrößerung 400x, Stapel aus je 30 bzw. 10 Bildern




Der Stapel aus nur 10 Bildern unten zeigt die Stomata sauberer, der Stapel darüber aus 30 Bildern lässt das umliegende Gewebe besser erkennen, zum Preis einiger Stacking-Artefakte.
Vielen Dank fĂĽrs lesen, Anregung und Kritik sind wie immer willkommen.
Freundliche GrĂĽĂźe
Jörg Weiß
Mikroskopisches Kollegium Bonn
www.mikroskopie-bonn.de
1-mal bearbeitet. Zuletzt am 17.04.17 20:20.